Saat dua atom atau lebih saling berdekatan, maka elektron elektron pada setiap atom akan mengalami interaksi dan akan membentuk suatu susunan elektron baru pada seputar inti atom. Pada kondisi ini, terjadilah suatu ikatan kimia. Ikatan kimia merupakan suatu ikatan yang terjadi antara antar atom, ion, atau antar molekul.
Gas mulia (Golongan IV) merupakan golongan atom yang sulit untuk berikatan dengan atom lain.Hal ini xisebabkan karena pada Gas mulia memiliki sifat yang stabil.
Konfigurasi elektron pada gas mulia :
2 He : 2
12 Ne : 2, 8
18 Ar : 2, 8, 8
36 Kr : 2, 8, 18, 8
54 Xe : 2, 8, 18, 18, 8
Dari beberapa konfigurasi di atas, ilmuwan Lewis dan Kossel menarik kesimpulan bahwa konfigurasi elektron pada atom akan stabil saat atom memiliki elektron terluar 2 ( duplet) dan 8 (oktet) yang dikenal dengan istilah aturan oktet.
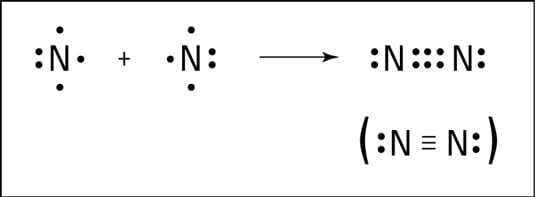
Ikatan kimia ditentukan oleh elektron pada kulit terluar dari suatu atom. Macam macam ikatan kimia yaitu :
1. Ikatan ion ( Elektrovalen )
Ikatan yang terbentuk karena adanya perpindahan atau transfer elektron dari suatu atom ke atom yang lain. Hal ini terjadi jika atom unsur yang memiliki energi ionisasi atau keeletronegativitas rendah melepas elektron valensi sehingga terbentuk ion positif (karena kehilangan elektron) dan atom atom unsur lain yang memiliki afinitas elektron atau keeletronegativitas besar menerima elektron sehingga terbentuk ion negatif (Ghalib, 2009). Pada umumnya, unsur yang mampu melepas elektron adalah unsur logam. Sedangkan unsur yang menerima elektron adalah unsur non logam.
Contoh
💦 Ikatan pada senyawa NaCl
11 Na : 2, 8, 1
17 Cl : 2, 8, 7
Na → Na⁺ + e⁻
(2,8,1) (2,8)
Cl + e⁻ → Cl⁻
(2,8,7) (2,8,8)
Na memiliki potensial ionisasi rendah dan berelektronegativitas rendah, sedangkan Cl memiliki afinitas elektron tinggi dan berelektronegativitas tinggi. Atom Na melepas 1 elektron dan atom Cl menerima 1 elektron. Sehingga antara ion Na⁺ dan Cl⁻ dengan adanya gaya tarik menarik elektrostatis akan membentuk senyawa NaCl.
💦 Ikatan pada senyawa Na₂O
11 Na : 2, 8, 1
₈O : 2,6
Na → Na⁺ + e⁻
(2,8,1) (2,8)
O + 2e → O²⁻
(2,6) (2,8)
Untuk mencapai oktet, maka Na harus melepas 1 elektron dan menjadi kation Na⁺. Dan O akan menerima 2 elektron menjadi anion O²⁻. Sehingga reaksi yang terjadi yaitu :
Na → Na⁺ + e⁻ (x2)
O + 2e → O²⁻ (x1)
――――――――――――― +
2Na + O → 2Na⁺ + O²⁻ →Na₂O
Senyawa yang memiliki ikatan ion antara lain :
a. Golongan alkali ( IA ) [Kecuali atom H] dengan golongan halogen (VIIA)
ex: NaF, KI, CsF
b. Golongan alkali (IA) [Kecuali atom H] dengan golongan oksigen (VIA)
ex : Na₂S, Rb₂S, Na₂O
c. Golongan alkali tanah (IIA) dengan golongan oksigen (VIA)
ex : CaO. BaO, MgS
2. Ikatan Kovalen